Je me pose des questions sur les essais cliniques
« Qu’est-ce qu’un essai clinique ? Comment m’informer ? Suis-je concerné et pourquoi y participer ? Est-ce risqué ? Est-ce que ça va marcher ? » L’essai clinique est un protocole peu médiatisé. Il soulève de nombreuses interrogations chez les patients et les aidants qui, souvent, ne savent pas où trouver les réponses à leurs questions.
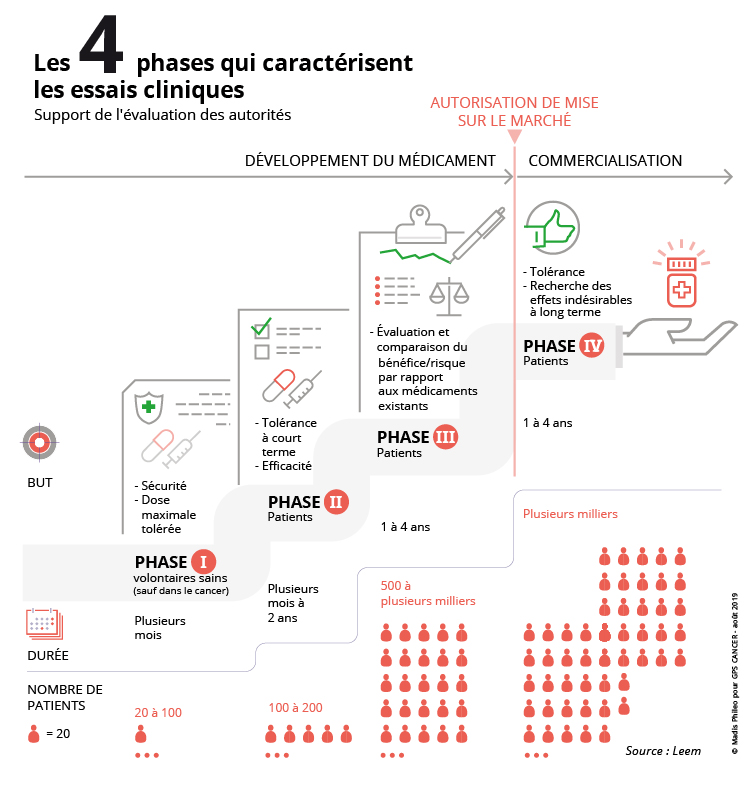
Selon l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), « un essai clinique est une recherche biomédicale organisée et pratiquée sur l’Homme en vue du développement des connaissances biologiques ou médicales ». C’est donc une phase expérimentale humaine qui intervient après les recherches en laboratoire pour évaluer la sécurité, l’efficacité et la tolérance de l’utilisation d’un nouveau traitement. On parle aussi d’étude clinique.
Le patient susceptible d’entrer (on dit aussi être inclus) dans un essai clinique est sélectionné en fonction de critères propres à l’essai et strictement définis dans le protocole (document descriptif de l’objectif et de la méthodologie de l’essai validé par les autorités). Ils comprennent des critères d’inclusion (âge, sexe, maladie, traitements précédents, etc.) qu’il est indispensable de remplir pour participer à l’essai, et des critères d’exclusion qui empêchent d’y participer (antécédents médicaux, traitements actuels, etc.). Dans tous les cas, le patient candidat à un essai clinique doit prendre connaissance du protocole lors d’un entretien avec son médecin, et préalablement accepter que ses informations personnelles et médicales soient recueillies.
Participer à un essai clinique présente plusieurs intérêts, que ce soit lors d’un premier cancer ou d’une récidive. Il permet :
- d’essayer un traitement prometteur (selon la phase d’essai que l’on intègre) ;
- de tenter une alternative quand tous les autres traitements ont échoué ;
- de faire avancer la recherche ;
- et, au-delà de soi, d’aider les futurs patients qui bénéficieront des nouvelles connaissances acquises.
Rappelons ici que les traitements standard dont bénéficient les patients aujourd’hui, ont été testés et évalués en leur temps de la même manière par d’autres patients afin de pouvoir obtenir leur autorisation de mise sur le marché (ou AMM, document officiel délivré par les autorités de santé).
Lise, 23 ans, en rémission d’un sarcome diagnostiqué en 2014, récidivant en 2017
Agnès, 44 ans, maman de Constance, décédée d’une leucémie à 11 ans après 7 ans de combat
L’essai clinique soulève beaucoup de questions, par la nature de ce protocole qui le fait assimiler souvent à une expérimentation, mais aussi du fait de la complexité à s’informer et comprendre le sujet.
Lise, 23 ans, en rémission d’un sarcome diagnostiqué en 2014, récidivant en 2017
Participer à un essai clinique peut faire peur, par méconnaissance. C’est pourquoi il faut d’abord poser vos questions aux médecins qui vous entourent. Chacun aura des réponses à vous apporter, que ce soit avant un essai clinique (possible ou non) ou pendant l’essai.
- Avant : vous pouvez obtenir les informations au sujet des essais cliniques auprès de votre spécialiste ou de votre généraliste : ses étapes, du choix de l’essai clinique jusqu’à la publication des résultats ; dans quels centres les essais ont-ils lieu ; peut-on demander un deuxième avis…
- Pendant : vous pouvez vous rapprocher
- du médecin investigateur qui dirige l’essai au sein de l’établissement,
- de l’investigateur principal coordonnateur de l’étude,
- ou de l’infirmière de recherche clinique.
- À tout moment : vous pouvez en parler à votre médecin traitant ou avec une association de patients.
Agnès, 44 ans, maman de Constance, décédée d’une leucémie à 11 ans après 7 ans de combat
Lise, 23 ans, en rémission d’un sarcome diagnostiqué en 2014, récidivant en 201
Lise, 23 ans, en rémission d’un sarcome diagnostiqué en 2014, récidivant en 2017
Il faut apprendre à interroger, à poser toutes les questions qui semblent nécessaires sans appréhension, mais aussi à faire confiance aux professionnels. Être rassuré, se rassurer permet de mieux avancer, en avançant conjointement avec l’équipe médicale.
Lise, 23 ans, en rémission d’un sarcome diagnostiqué en 2014, récidivant en 2017
S’il n’y a pas urgence, il est conseillé de prendre le temps de réfléchir et de se faire confiance. On peut hésiter et, dans ce cas, demander d’autres avis est parfois nécessaire.
Jean-Louis, 61 ans, atteint d’un cancer du rein métastatique découvert en 2000
De prime abord, le terme « essai » peut laisser penser qu’il n’y a aucune garantie de réussite ou que le protocole présente un risque, ce qui peut être le cas. Il faut être préparé à l’éventualité que l’essai ne soit pas concluant, tout comme un traitement peut ne pas être satisfaisant.
Jean-Louis, 61 ans, atteint d’un cancer du rein métastatique découvert en 2000
- Aucun patient ne peut entrer dans un essai clinique sans en avoir été informé préalablement. Il devra donner son accord formel pour y participer en signant un consentement éclairé, après avoir lu et compris la notice d’information, document qui présente l’essai en question et lui permet d’en connaître les bénéfices espérés, comme les risques encourus.
- À tout moment, le patient a le droit de décider de renoncer à l’essai ou de sortir de l’essai, quel que soit l’avis du médecin et même s’il a signé un consentement éclairé, sans que cela ait de conséquence sur son suivi médical ni sur la qualité des soins ultérieurs qui lui seront prodigués.
La Loi Huriet-Sérusclat encadre les essais cliniques en France depuis 1988. Conformément aux articles L.1121-1 et suivants du Code de la Santé Publique et les Bonnes Pratiques Cliniques, le protocole doit avoir été autorisé par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) et avoir reçu l’avis favorable d’un Comité de Protection des Personnes. Ces deux instances assureront au patient un suivi régulier et une évaluation constante de la sécurité.
Enfin, les essais cliniques doivent respecter un certain nombre de règles éthiques selon la déclaration d’Helsinki de l’Association Médicale Mondiale.
Publication : novembre 2019
DOCUMENT À TÉLÉCHARGER
 |
Brochure « Les essais cliniques en 10 questions », éditée par Les entreprises du médicament Télécharger le document |
POUR PLUS D’INFORMATION, VOUS POUVEZ CONSULTER LES SITES SUIVANTS
|
ANSM • Agence nationale de sécurité du médicament et des produits de santé |
 |
INCa • Institut national du cancer |